







《复旦有机化学PPT课件下载(共57页)》是由用户上传到老师板报网,本为文库资料,大小为3.23 MB,总共有57页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 57页
- 3.23 MB
- VIP模板
- ppt
- 数字产品不支持退货
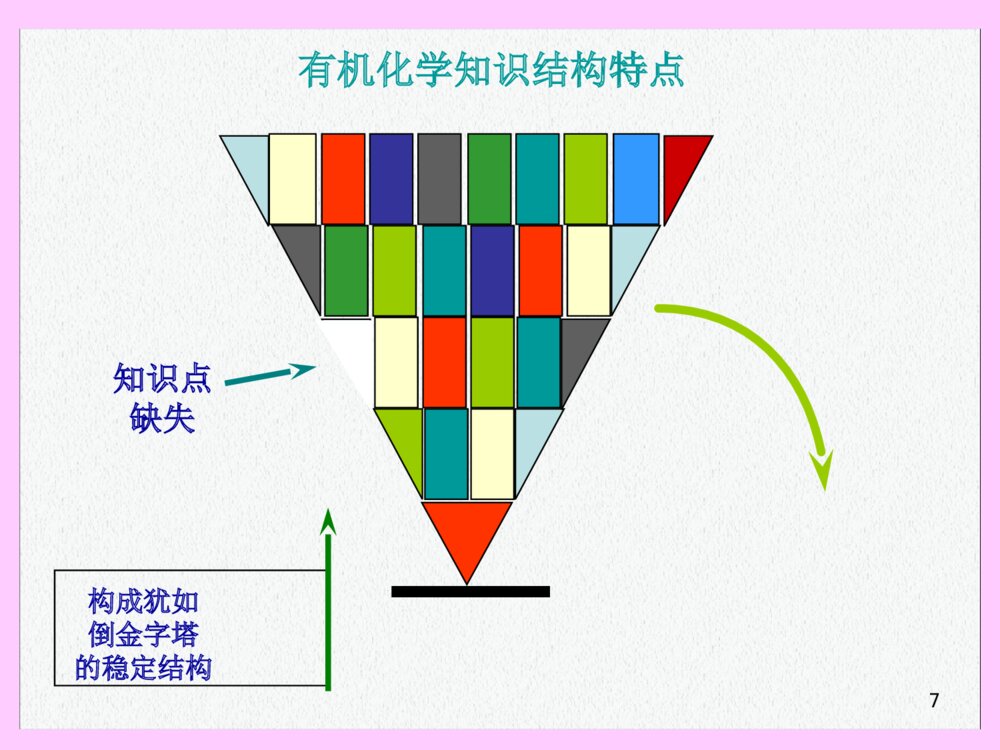
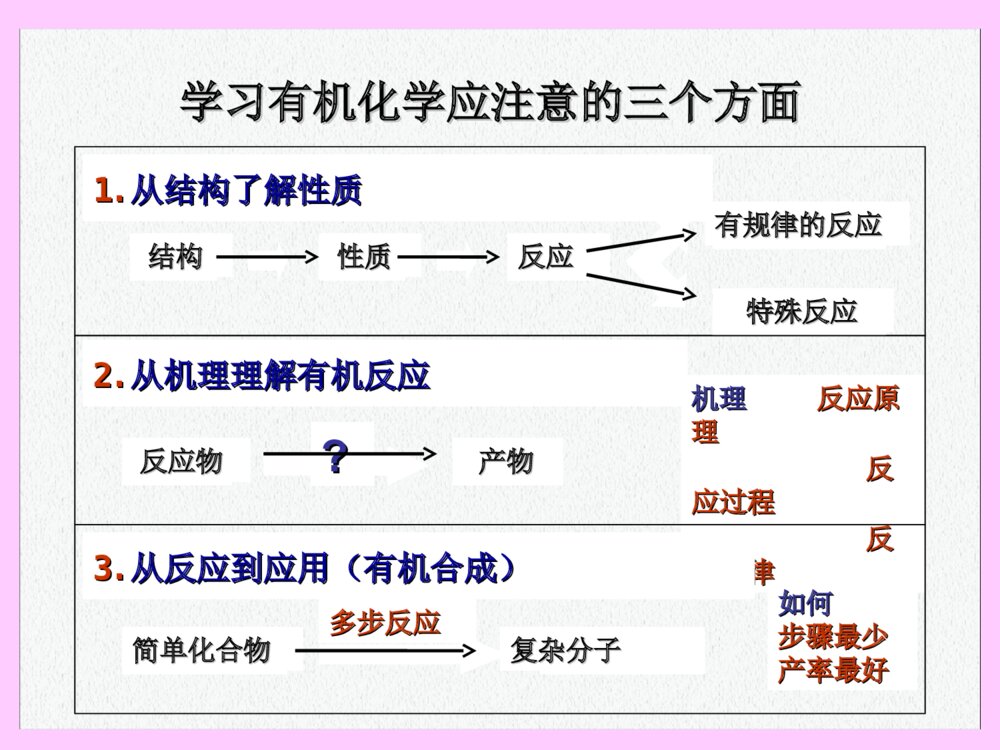
12时间:周一3-4周五1-2地点:H4105Email:wanghui@fudan.edu.cnTel:65642796办公室:化学楼332教材:教材:基础有机化学(第三版)(上、下册)基础有机化学(第三版)(上、下册)邢其毅、裴伟伟、徐瑞秋、裴坚编邢其毅、裴伟伟、徐瑞秋、裴坚编高等教育出版社(高等教育出版社(20052005))配套辅导教材:配套辅导教材:基础有机化学习题解析基础有机化学习题解析裴伟伟编裴伟伟编高等教育出版社(高等教育出版社(20062006))EighthEditionEighthEditionSixthEditionSixthEditionT.W.GrahamSolomensT.W.GrahamSolomensCraigB.FryhleCraigB.FryhleJohnMcMurryJohnMcMurry化学工业出版社化学工业出版社参考教材:参考教材:教学安排教学安排第第1~41~4,,6~14,176~14,17章内容章内容注:注:第第55章波谱学内容将由章波谱学内容将由““谱学导论谱学导论””课程介绍课程介绍考试:考试:(1)(1)期中考:第期中考:第11~8~8章内容章内容((第第1010周周))(2)(2)期末考:全部期末考:全部内容内容6如何学习如何学习有机化学有机化学??知识点缺失有机化学知识结构特点构成犹如倒金字塔的稳定结构7知识结构倒塌!!!如果某知识点缺失…..8理解:设法理解你所学到的知识记忆:无论忘记什么,之后总还得补上本课程所有的知识点都不能忽视循序渐进本课程的知识需要不断的积累9反应物反应物产物产物学习有机化学应注意的三个方面学习有机化学应注意的三个方面1.1.从结构了解性质从结构了解性质反应反应性质性质结构结构2.2.从机理理解有机反应从机理理解有机反应有规律的反应有规律的反应特殊反应特殊反应机理机理反应原反应原理理反反应过程应过程反反应规律应规律3.3.从反应到应用(有机合成)从反应到应用(有机合成)简单化合物简单化合物多步反应多步反应复杂分子复杂分子??反应物反应物如何如何步骤最少步骤最少产率最好产率最好第一章绪论第一章绪论主要内容有机化学和有机化合物有机化合物的结构及表达方式碳的杂化轨道与有机分子结构有机化合物的几何形象与立体结构有机化合物的反应类型(按底物变化分类)有机反应中的酸碱概念生命论与早期的有机化学生命论与早期的有机化学((18281828年之年之前)前)有机化合物有机化合物最早的有机化合物来自最早的有机化合物来自于动植物体(有机体)于动植物体(有机体)生命论生命论(Vitalism)认为:认为:有机化合物只能由有机体产生。无机化合物则存有机化合物只能由有机体产生。无机化合物则存在于无生命的矿藏中,同时也可由有机体产生。在于无生命的矿藏中,同时也可由有机体产生。一一..有机化学和有机化合有机化学和有机化合物物FriedrichWöhler(German)FriedrichWöhler(German)的实验的实验(1828)(1828)由腈酸铵由腈酸铵(无机物)(无机物)制得尿素制得尿素(有机物)(有机物)inorganicorganicH2NCNH2ONH4CNO+-有机化学(有机化学(OrganicChemistryOrganicChemistry))————研究研究有机化合物有机化合物的结构和性的结构和性质的科学质的科学有机化合物有机化合物————含碳的化合物含碳的化合物HHCCNNOOFFPPSSClClBrBrIISiSiBB有机化合物中常见的元素OCOCH3COOHÒÒõ£Ë®ÑîËáAspirinOOHHOOOHOH维生素CVitaminCNHNOOOMeOMeOMeMeO2CMeOHHHHOMeH利血平ReserpineS.M.Z.»Ç°·¼×噁ßòH2NSNHOONOCH3OOCH3HH3COH3COCH310辅酶Q10CoenzymeQ,Ubiquinones身边的有机化合物身边的有机化合物又称抗皱修护因子。有强抗氧化剂作用。又称抗皱修护因子。有强抗氧化剂作用。存在于印度萝芙木,用于治疗高血压COHHOCH3CH3NNNNH2H2NNH2三聚氰胺三聚氰胺双酚双酚AAOHNNR苏丹红苏丹红有机化合物的特点:有机化合物的特点:1.1.对热不稳定,易燃烧(极少数例外)对热不稳定,易燃烧(极少数例外)2.2.熔点较低(一般在熔点较低(一般在250250ooCC以下)以下)3.3.易溶解于有机溶剂中,难溶于水。易溶解于有机溶剂中,难溶于水。4.4.同分异构体较多(总数达同分异构体较多(总数达80008000多万种)多万种)C2H6OHCHHOCHHHHCHHCHHOH甲醚乙醇18化学键离子键:原子间电子转移共价键:原子键共用电子对配位键金属键:自由电子与金属离子作用;多原子键,无方向性和饱和性八隅体规则二二..有机化合物的基本结有机化合物的基本结构构(一)化学键19共价键理论要点•两个条件:自旋相反、末成对电子•两个原则:方向性、饱和性•两种类型:σ键、π键•三种形式:单键、双键、叁键共价键概念共价键概念八隅体八隅体(Octet)(Octet)::原子总是倾向获得与惰性气体相同的价原子总是倾向获得与惰性气体相同的价电电子排布子排布((价电子层达到价电子层达到88个电子的稳定结个电子的稳定结构构))共价键共价键((covalentbond)covalentbond)::原子间通过共用电子对相原子间通过共用电子对相互结互结合而成键(电子共享)合而成键(电子共享)非极性共价键非极性共价键极性共价键极性共价键C:1sC:1s222s2s222p2p22•最外层最外层44个价电子个价电子•中等电负性中等电负性•可通过与其它原子共享电子满足八隅体(成共价键)可通过与其它原子共享电子满足八隅体(成共价键)有机分子中的化学键有机分子中的化学键————共价键共价键碳是四价的碳是四价的C+C+++HHHHHCHHH+C+HHHHC++HCHCHHCH4H2CCH2C+HHC+CHCHHCCH(二)有机化合物结构的常用表达方式(二)有机化合物结构的常用表达方式LewisLewis电子式电子式价键式价键式缩写式缩写式甲烷甲烷乙烯乙烯乙炔乙炔单键单键双键双键叁键叁键+C+++HHHHHCHHH+C+HHHHC++HCHCHHCH4H2CCH2C+HHC+CHCHHCCH+C++HHHClHCHHClCH3Cl+C++HHHC++HHO+HHCHHCHHOHCH3CH2OH+C++HHHCO+HC++HHHCHHCOCHHHH3CCOCH3CH3CCH3OCH3ClCH3COCH3氯甲烷氯甲烷乙醇乙醇丙酮丙酮LewisLewis电子式电子式价键式价键式缩写式缩写式CCCCCCCCCCCCCCCCCCCCC链状链状环状环状单键单键————由一对共享电子形成的键由一对共享电子形成的键双键双键————由两对共享电子形成的键由两对共享电子形成的键叁键叁键————由三对共享电子形成的键由三对共享电子形成的键碳与碳之间可以成键,形成复杂化合物碳与碳之间可以成键,形成复杂化合物电负性、分子的极性一些元素一些元素的电负性的电负性HCNOFClBrISP2.12.53.03.54.02.12.53.02.82.5非极性共价键:极性共价键:离子键:K—FNa—Cl(0.8)(4.0)(0.9)(3.0)C—ClC=O(2.5)(3.0)(2.5)(3.5)C—H(2.5)(2.1)电负性电负性((原子实对价电子的吸引力原子实对价电子的吸引力))分子的极性分子的极性(分子中化学键极性的向量和)(分子中化学键极性的向量和)HCHHHOCOHCHClCl非极性分子非极性分子极性分子极性分子CClClCl的电负性(吸电子性)使得的电负性(吸电子性)使得与其相连的与其相连的CC上显部分电正性上显部分电正性(三)(三)..碳的轨道杂化与有机分子结构碳的轨道杂化与有机分子结构原子轨道理论(s轨道、p轨道)共价键:两个带有自旋反平行单电子轨道的交叠(键和键)杂化轨道理论:成键之前原子轨道进行了重组HCHHHCCHHHHCCHH四面体型分子四面体型分子平面型分子平面型分子直线型分子直线型分子C-HC-H键长度相等键长度相等有一根键较活泼有一根键较活泼有两根键较活泼有两根键较活泼2s2px2py2pz2s2px2py2pz跃迁原子轨道重组4个sp3轨道C:1s22s22p2碳原子的几种轨道杂化碳原子的几种轨道杂化1.1.spsp33杂化杂化109.5o四面体型四面体型HCHHH¼ü(sp3-s)HCHH¼ü(sp3-s)HCHH¼ü(sp3-sp3)HCHHCl¼ü(sp3-p)甲烷(CH4)的成键示意CHHHHCHHHH键键轴对称方式交叠2.2.spsp22杂化杂化2s2px2py2pz2s2px2py2pz跃迁原子轨道重组3个sp2轨道2pz120o平面型平面型乙烯(CH2=CH2)的成键示意Csp2¹ìµÀp¹ìµÀC+HHHHCHHp¹ìµÀCHHCCHHHH¼ü(sp2-s)¼ü(sp2-sp2)¼ü(p-p)CCHHHCH3¼ü(sp2-sp3)OCHCH3¼ü(sp2-sp2)¼ü(p-p)键侧面交叠(电子云结合较松散)3.3.spsp杂化杂化2s2px2py2pz2s2px2py2pz跃迁原子轨道重组sp2py2pz180o直线型直线型乙炔(CHCH)的成键示意:CCHH¼ü(sp-s)¼ü(sp-sp)2¼ü(p-p)¼ü(sp-sp2)CCH3CCHCH2Csp¹ìµÀpy+HHCHCHpzCpypz(四)(四)有机化合物的几何形象与立体结构有机化合物的几何形象与立体结构1.1.烷烃:烷烃:四面体型四面体型HCHHHHCHHH平面模型四面体模型CH2Cl2HCClHClHCClClHHCHClCl(只有一种物质)CH4(两者不同)HCClIBrHCBrClIHCBrClIÒ»¶Ô»¥Îª¾µÏñµÄÁ¢ÌåÒì¹¹ÌåCHClBrIÂÈäåµâ¼×Í飨ÓÐÁ½¸öÁ¢ÌåÒì¹¹Ì壩HCClIBrHCClIBr平面模型四面体模型伞形式HCBrClI键向后键向前在平面上ÈýÕß¾ù²»Í¬用键线式简化结构式用键线式简化结构式CCCCHHHHHHHHHH键线式H2CH2CCH2CH2CH2CH2CH3CHCH2CH3CH3CCCCC不正确的表达方式H3CCHCH2CH3CH3CH3CH2CH2CH3H2CH2COCH2CH2O省略了什么?省略了什么?2.2.烯烃:平面型烯烃:平面型H2CCH2平面型CCHHHHCH3CHCHCH3有顺反异构体CCH3CHCH3HCCH3CHHCH3(双键不能旋转)H3CCH3H3CCH3键线式顺式反式oror3.3.炔烃:直线型炔烃:直线型HCCHCCHHÖ±ÏßÐÍH3CCCCH2CH3CCCH2CH3H3CCH2CH3H3C¼üÏßʽCH3H3C²»ÕýÈ·µÄ±í´ïʽor•链状化合物链状化合物碳环杂环芳环不饱和饱和NO有机化合物碳链的多样性有机化合物碳链的多样性•环状化合物环状化合物炔烃炔烃烯烃烯烃烷烃烷烃官能团名称官能团名称化合物类型化合物类型有机化合物官能团的多样性有机化合物官能团的多样性CCCCX官能团官能团卤代烃卤代烃OHOR1R2醇、酚醇、酚醚醚碳碳双键碳碳双键碳碳叁键碳碳叁键卤素原子卤素原子羟基羟基醚基醚基官能团名称官能团名称化合物类型化合物类型官能团官能团氨基氨基羰基羰基羧基羧基腈腈胺胺羧酸羧酸酮酮醛醛NR1R3(H)R2(H)CNOCHOCOCOH醛基醛基氰基氰基官能团名称官能团名称化合物类型化合物类型官能团官能团酰卤基酰卤基酰氨基酰氨基酯基酯基酸酐基酸酐基酰胺酰胺酯酯酸酐酸酐酰卤酰卤OCXOCOOCOCOROCNR2(H)R1(H)有机化合物的同分异构现象和同分异构体有机化合物的同分异构现象和同分异构体((CONSTITUTIONALISOMERSCONSTITUTIONALISOMERS,,STRUCTURALISOMERSSTRUCTURALISOMERS))同分异构体同分异构体具有相同的分子式,但原子的连接顺序不同的分具有相同的分子式,但原子的连接顺序不同的分子子CH4C2H6C3H8无异构体无异构体C1~C3C1~C3烷烃无异构现象烷烃无异构现象C4C4以上烷烃出现同分异构现象以上烷烃出现同分异构现象C4H10C5H12C6H14C20H42366,319同分异构体数同分异构体数235预备知识:碳原子的四种类预备知识:碳原子的四种类型型11CC(伯碳,一级碳)(伯碳,一级碳)primarycarbonprimarycarbon22CC(仲碳,二级碳)(仲碳,二级碳)secondarycarbonsecondarycarbontertiarycarbontertiarycarbon33CC(叔碳,三级碳)(叔碳,三级碳)44CC(季碳,四级碳)(季碳,四级碳)quaternarycarbonquaternarycarbonH3CCH2CH2CH3H3CCHCH3CH3H3CCCH3CH3CH311HH(伯氢)(伯氢)22HH(仲氢)(仲氢)33HH(叔氢)(叔氢)H3CCH2CH2CH2CH3H3CCHCH2CH3CH3CHCH2CCH3CH3CH3H3CCH3二种类型二种类型22CC二种类型二种类型11CC二种类型二种类型11CC分析下列化合物所含碳原子种类分析下列化合物所含碳原子种类预备知识:碳原子种类的预备知识:碳原子种类的扩展扩展H3CCH2CH2H3CCCH3CH3H3CCHCH311自由基自由基(伯自由基)(伯自由基)22自由基自由基(仲自由基)(仲自由基)33自由基自由基(叔自由基)(叔自由基)11碳负离子碳负离子(伯碳负离子)(伯碳负离子)33碳正离子碳正离子(伯碳正离子)(伯碳正离子)H3CCH2CH2CH2H3CCCH3CH3PrimaryradicalPrimaryradicalSecondaryradicalSecondaryradicalTertiaryradicalTertiaryradicalPrimaryPrimarycarbanioncarbanionTertiaryTertiarycarbocationcarbocation有机化合物分类还原还原硝基苯硝基苯CC66HH55NONO22硝基化合物硝基化合物亲核加成亲核加成乙腈乙腈CHCH33CCNN腈化物腈化物碱或亲核试剂碱或亲核试剂乙胺乙胺CHCH33CHCH22NHNH22胺胺含氮有机物含氮有机物亲核取代、消除亲核取代、消除氯乙烷氯乙烷CHCH33CHCH22ClCl卤代物卤代物芳香亲电取代芳香亲电取代苯苯芳烃芳烃亲电加成亲电加成丁二烯丁二烯CHCH22=CHCH=CH=CHCH=CH22二烯二烯亲电加成亲电加成乙炔乙炔HCHCCHCH炔烃炔烃亲电加成亲电加成乙烯乙烯CHCH22=CH=CH22烯烃烯烃自由基取代自由基取代乙烷乙烷CHCH33CHCH33烷烃烷烃碳氢化合物碳氢化合物典型反应类型典型反应类型名称名称举例举例开环开环环氧乙烷环氧乙烷环氧化合物环氧化合物乙醚乙醚CHCH33CHCH22OCHOCH22CHCH33醚醚芳香亲电取代芳香亲电取代苯酚苯酚CC66HH55OHOH酚酚亲核取代亲核取代N-N-甲基乙酰胺甲基乙酰胺CHCH33CONH(CHCONH(CH33))酰胺酰胺亲核取代亲核取代乙酸乙酯乙酸乙酯CHCH33COOCHCOOCH22CHCH33酯酯亲核取代亲核取代乙酸酐乙酸酐(CH(CH33CO)CO)22OO酸酐酸酐亲核取代亲核取代乙酰氯乙酰氯CHCH33COClCOCl酰卤酰卤羧酸衍生物羧酸衍生物亲核加成、取代亲核加成、取代乙酸乙酸CHCH33COOHCOOH羧酸羧酸亲核加成亲核加成丙酮丙酮CHCH33COCHCOCH33酮酮亲核加成亲核加成乙醛乙醛CHCH33CHOCHO醛醛亲核取代、消除亲核取代、消除乙醇乙醇CHCH33CHCH22OHOH醇醇含氧有机物含氧有机物典型反应类型典型反应类型名称名称举例举例O分类(续)分类(续)亲核取代、消除亲核取代、消除取代反应:一个基团被另一个基团置取代反应:一个基团被另一个基团置换换h+Cl2HCHHH+HCHClHHClCN++BrRCHHBrNCCHHR+NO2+HOHHNO3H2SO4HHHHHHHHHHH亲核取代亲核取代(五)有机化合物的反应类型(按底物变化分类)自由基取代自由基取代亲电取代亲电取代加成反应:不饱和化合物转变为饱和化合物加成反应:不饱和化合物转变为饱和化合物自由基加成自由基加成亲核加成亲核加成亲电加成亲电加成CCH3C+HBrCCCH3BrROORHHHHHHHRCRO+CH3MgIRCROMgICH3CCH3C+HClCCCH3HClHHHHHH氧化氧化//还原反应还原反应重排反应重排反应消除反应:饱和化合物转变为不饱和化合物消除反应:饱和化合物转变为不饱和化合物+HClBaseCCH3CCCCH3HClHHHHHHLiAlH4H3CHCCHH2CCOHHHH3CHCCHH2CCHOPCCOOHBrőnstedBrőnsted酸碱理论酸碱理论凡能凡能给出质子给出质子的物质是酸,能的物质是酸,能接受质子接受质子的物质是的物质是碱。碱。HHCl+NaCl+NaOHOH=NaCl+=NaCl+HHOHOHLewisLewis酸碱理论酸碱理论酸是能酸是能接受一对电子接受一对电子成共价键的物质,成共价键的物质,碱是可以碱是可以提供一对电子提供一对电子形成共价键的物质。形成共价键的物质。Lewis酸BF3B:2s22p1AlCl3Al:3s23p1sp2杂化,有一个空的p轨道Lewis碱NH3,ROH有孤对电子ӨOR,ӨOH带负电荷CH2=CH2,苯有电子对(六)有机反应中的酸碱反应概念三、有机化合物的反应机理(P.133,4.3.1-2)按键断裂形式分类均裂(自由基型反应)用单钩箭头表示单个电子的转移,箭头方向为电子转移的方向例:ClHCH3HClCH3+ABA+B自由基或游离基freeradical异裂(离子型反应)用双钩箭头表示一对电子的转移,箭头方向为电子转移的方向例:H3CCCH3CH3ClH3CCCH3CH3Cl+H2CCHOHBrCH2CH3HOCH2CH3+BrCH3HH2CCCH3HHABA+B反应中间体intermediates按反应步骤分类分步:反应中经过自由基或正负离子等中间体+过渡态ClhCl2ClClCH3H+CH3CH3ClCl+Cl++ClHClCH3协同:反应中键的断裂和生成同时发生,不经过自由基或离子等中间体课后习题:课后习题:p4,习题1-1,p6,习题1-2,p9,习题1-3,p23,习题1-10,p24,习题1-12,p31,习题2-1



















